Kierownik:
dr hab. inż. Iwona Kowalska
e-mail: Iwona.Kowalska@iung.pulawy.pl
tel. 81 4786 883
Sekretariat
e-mail: biochem@iung.pulawy.pl
tel. 81 4786 880
Siedziba Zakładu znajduje się w Centrum INCBR
adres: ul. Krańcowa 8, 24-100 Puławy
Profil badawczy Zakładu
- analizy jakościowe i ilościowe związków organicznych obecnych w roślinach i w żywności funkcjonalniej
- badania budowy chemicznej, aktywności biologicznej, występowania oraz możliwości praktycznego wykorzystania biologicznie czynnych substancji swoistych roślin
- opracowanie i doskonalenie metod oznaczania zawartości wybranych składników roślinnych
- badania jakości biomasy pod kątem przydatności do produkcji biogazu;
- analizy elementarne materiału roślinnego pod kątem zawartości pierwiastków biogennych
- określanie wpływu czynników środowiskowych, agrotechnicznych i genetycznych na skład jakościowy i ilościowy substancji wpływających na wartość żywieniową roślin uprawnych
- badania roślinnych odpadów poekstrakcyjnych
- badania wpływu czynników biotycznych i abiotycznych na skład chemiczny roślin
Oferta
-
- Wyznaczanie dokładnej masy cząsteczkowej oraz wzorów sumarycznych związków chemicznych z dokładnością pomiaru poniżej 1 ppm i przy uwzględnieniu rozkładu izotopowego; zarówno dla związków czystych, jak i będących składnikami mieszanin rozdzielanych za pomocą GC lub UHPLC, z użyciem spektrometru mas wysokiej rozdzielczości. Możliwe jest również wyznaczanie dokładnej masy jonów fragmentacyjnych dla analizowanych związków.
- Określanie struktur substancji naturalnych – NMR.
- Wykonywanie ekstraktów roślinnych, ich oczyszczanie oraz izolacja standardów związków do badań żywieniowych i aktywności biologicznej. Ekstrakcja olejków eterycznych.
- Oznaczanie w roślinach, produktach pochodzenia roślinnego, surowcach i produktach farmaceutycznych:
- saponin steroidowych i triterpenowych oraz glikoalkaloidów steroidowych –UHPLC-MS,
- zawartości związków fenolowych (kwasy fenolowe, flawonoidy i izoflawonoidy, katechiny, antocyjany) – HPLC-DAD, UHPLC-MS,
- kwasów hydroksamowych – UHPLC-MS,
- glikozydów cyjanogennych – UHPLC-MS,
- witamin rozpuszczalnych w wodzie (witaminy C i z grupy B) – UHPLC-MS,
- mono- i oligosacharydów – UHPLC-MS,
- glukozynolanów – UHPLC-MS,
- aminokwasów – UHPLC-MS/MS (w nawozach, stymulatorach wzrostu i roślinach).
- Oznaczania zawartości włókna surowego oraz jego frakcji tzw. frakcji neutralno-detergentowej (NDF), kwaśno-detergentowej (ADF) i kwaśno-detergentowej ligniny (ADL) w materiale biologicznym. Oznaczenie zawartości celulozy, hemicelulozy i ligniny.
- Analizy zawartości pierwiastków biogennych C, H, N, S i O w próbkach roślinnych, glebie, biomasie, paliwach, ściekach itp.
- Oznaczanie zawartość białka ogólnego, wartości kalorycznej i teoretycznego uzysku biogazu dla badanego materiału.
- Badania nad przebiegiem procesu fermentacji metanowej w trybie stacjonarnym i ciągłym, z wykorzystaniem różnych substratów, nad oceną ich przydatności do produkcji biogazu poprzez wyznaczenie uzysku biogazu i metanu.
- Badania nad wpływem substancji szkodliwych lub stymulujących proces fermentacji metanowej.
- Badanie składu biogazu pod kątem zawartości metanu, dwutlenku węgla i tlenu (w zakresie od 0 do 100% z dokładnością do 0.5%), siarkowodoru (w zakresie 0 – 10000 ppm) i amoniaku (w zakresie 0-1000 ppm).
Wyposażenie
Laboratorium NMR – spektroskopii jądrowego rezonansu magnetycznego
Laboratorium specjalizuje się w analizie fitochemicznej – związków organicznych obecnych w roślinach – w tym metabolitów swoistych (drugorzędowych), m.in. kwasów fenolowych, flawonoidów i saponin. Posiadamy wypracowany zestaw eksperymentów, które skutecznie pozwalają badać rodzaj aglikonu i połączenia między cukrami. Oferujemy zarówno analizy jakościowe, jak i ilościowe metodą ERETIC2, ale także fachową pomoc w interpretacji wyników.

Spektrometr AVANCE III HD 500 MHz Bruker
Laboratorium wyposażone jest w spektrometr, wraz z głowicami pomiarowymi do pomiarów próbek ciekłych (w zakresie 20-100°C):
- PA BBI 500S1 H-BB-D-05 Z – szerokopasmowa (zakres 31P-109Ag, w tym 13C, 15N), gradientowa (oś z), inwersyjna ze szczególnym przeznaczeniem do pomiarów 1H oraz widm korelacyjnych, np. COSY, NOESY, HSQC, HMBC, itp.
- PA DUL 500S1 C-H-D-05 Z – dwujądrowa, do obserwacji 1H/13C, ze szczególnym przeznaczeniem do pomiarów 13C.
Rutynowo wykonujemy następujące eksperymenty:
- jednowymiarowe – 1H i 1H z supresją rozpuszczalnika, 13C (w tym InverseGated/DEPT/DEPTq i UDEFT), selektywne COSY, TOCSY (w tym CSSF-TOCSY), NOESY (w tym CSSF-NOESY), ROESY i step-NOESY, pomiar T1;
- dwuwymiarowe – dqf-COSY, 2D-TOCSY (również z supresją rozpuszczalnika), 2D-NOESY (również z supresją rozpuszczalnika), 2D-ROESY (również z supresją rozpuszczalnika), HSQC (również z supresją rozpuszczalnika), HSQC-TOCSY, HSQC-HECADE (pomiar JCH), H2BC, HMBC, CPMG-HSQMBC i J-HMBC (pomiar JCH), 1,1-ADEQUATE (tylko dla próbek bardzo stężonych), selektywne 2D-HSQC i selektywne 2D-HMBC.
Laboratorium MS – spektrometrii mas
Zakład Fitochemii specjalizuje się w analizie związków organicznych wytwarzanych przez rośliny, przede wszystkim należących do grupy metabolitów specyficznych (wtórnych). W laboratorium wykonywane są pomiary widm masowych w trybie MS i MSn (widma fragmentacyjne). Umożliwia to identyfikację badanych substancji, a także określenie ich ilościowej (również śladowej) zawartości w badanym materiale.

Spektrometr umożliwia ustalanie składu pierwiastkowego badanych związków chemicznych przez precyzyjny pomiar stosunku masy do ładunku tworzonych przez nie jonów. Hybrydowa konstrukcja oparta na analizatorze kwadrupolowym w połączeniu z analizatorem czasu przelotu, pozwala również na uzyskiwanie widm rozpadowych i identyfikację związków na ich podstawie. Spektrometr jest wyposażony w wymienne źródła jonów, pozwalające na zjonizowanie szerokiej gamy związków chemicznych przez elektrorozpylanie (ESI), jonizację chemiczną w ciśnieniu atmosferycznym (APCI, GC-APCI) lub fotojonizację w ciśnieniu atmosferycznym (APPI).
Dzięki połączeniu spektrometru z osprzętem towarzyszącym: systemami chromatografii ultrasprawnej cieczowej (UHPLC, Dionex UltiMate 3000RS), chromatografii gazowej (GC, Bruker Scion 456) oraz elektroforezy kapilarnej (CE, Agilent 7100) możliwe są wszechstronne analizy ilościowe i jakościowe skomplikowanych mieszanin związków chemicznych.
Zastosowania spektrometru:
- analizy metabolomiki ukierunkowanej i nieukierunkowanej w próbkach materiału roślinnego,
- analizy lipidomiki w próbkach nasion i innych materiałach,
- analizy ilościowe związków pozbawionych chromoforów z wykorzystaniem detektora uniwersalnego typu CAD,
- analizy FAME w różnych materiałach wejściowych,
- ustalanie masy cząsteczkowej i składu pierwiastkowego wyizolowanych metabolitów roślinnych.

W skład chromatografu cieczowego wchodzą dwa detektory: fotodiodowy (PDA), działający w zakresie fal 190–800 nm, oraz rozproszenia światła (ELSD), o częstotliwości zbierania danych 80 Hz. Spektrometr mas o niskiej rozdzielczości pozwala na skanowanie mas do 2000 Da oraz jest wyposażony w dwa źródła jonów: elektrorozpylanie (ESI) oraz jonizacja chemiczna pod ciśnieniem atmosferycznym (APCI). System UPLC-MS umożliwia prowadzenie szybkich (około 10 min) rozdziałów chromatograficznych w układzie odwróconych faz (RP) lub oddziaływań hydrofilowych (HILIC).
Zastosowania chromatografu:
- analizy ilościowe zawartości metabolitów specyficznych, w tym polifenoli, saponin, terpenoidów, alkaloidów, glikozydów i innych, w materiale roślinnym (ekstraktach roślinnych, paszach i produktach spożywczych),
- oznaczenia zawartości wolnych aminokwasów, monosacharydów oraz witamin,
- inne rodzaje jakościowych i ilościowych analiz UHPLC-MS.
Systemy wysokosprawnej chromatografii cieczowej HPLC
Zakład dysponuje chromatografami cieczowymi typu:
• HPLC – PDA – FLD firmy Dionex sprzężony z detektorem fotodiodowym w zakresie 180 – 560 nm oraz detektorem fluorescencyjnym (FDA) z zakresem przepływów od 0,5 do 8,0 ml/min,

- Półpreparatywny HPLC – ELSD firmy Gilson sprzężony z detektorem laserowym światła rozproszonego (ELSD) o zakresie przepływów od 1 do 12 ml/min.

Zastosowania chromatografów:
- izolacja metabolitów wtórnych (wysokiej czystości) do określenia struktury metodą NMR oraz badania aktywności biologicznych,
- izolacja substancji wzorcowych do standaryzacji materiałów biologicznych, żywności i pasz.
Laboratorium biomasy

Automatyczny analizator włókna surowego ANKOM DELTA
Automatyczny analizator włókna surowego model DELTA firmy ANKOM Technology jest aparatem pracującym w technologii „filter bag”. Analiza wykonywana jest zgodnie z metodą van Soest’a. Aparat daje możliwość pracy z dowolnymi próbkami biologicznymi, materiałem roślinnym, próbkami żywnościowymi itp. Posiada możliwość analizy 24 próbek jednocześnie. Dozowanie odczynników, sterowanie temperaturą, kontrola szczelności aparatu, mieszanie próbek, odpompowywanie pozostałości po ekstrakcji odbywa się w sposób w pełni automatyczny. Aparat cechuje się intuicyjnym panelem stresującym, umożliwiającym łatwe przełączanie pomiędzy metodami.
Zastosowanie analizatora:
- oznaczanie zawartości włókna surowego oraz jego frakcji tzw. frakcji neutralno-detergentowej (NDF), kwaśno-detergentowej (ADF) i kwaśno-detergentowej ligniny (ADL) w materiale biologicznym,
- oznaczanie zawartości celulozy, hemicelulozy i ligniny.
 Analizator elementarny CHNS/O
Analizator elementarny CHNS/O
Aparat FlashSmart firmy Thermo Scientific jest najnowocześniejszym, automatycznym analizatorem elementarnym na rynku, zapewniającym najbardziej powtarzalne i czułe pomiary różnego rodzaju próbek – węgli, biomasy, paliw stałych, płynnych, związków organicznych, farmaceutyków, itp. Analizator wykorzystuje metodę dynamicznego wysokotemperaturowego spalania próbek w piecu z elektronicznie sterowaną temperaturą, separację powstających gazów na kolumnie i ich detekcję na wysokiej czułości detektorze termo-przewodnościowym (TCD). Aparat wyposażony w dwa oddzielne piece reakcyjne z elektroniczną kontrolą temperatury, kompatybilne z reaktorami spaleniowo-redukcyjnymi do analizy C, H, N, S i reaktorem pirolitycznym do analizy O, pracujące niezależnie. Aparat jest w pełni automatyczny, umożliwia pracę bez konieczności przezbrajania, demontowania/montowania jakichkolwiek elementów. Przełączanie pomiędzy kanałami pomiarowymi odbywa się z poziomu oprogramowania sterującego.
Zastosowanie analizatora:
- analiza zawartości pierwiastków biogennych C, H, N, S i O w próbkach roślinnych, glebie, biomasie, paliwach, ściekach itp.,
- oznaczanie zawartość białka ogólnego, wartości kalorycznej i teoretycznego uzysku biogazu dla badanego materiału.
 Zestaw fermentorów Biogas Test Plant (BTPs)
Zestaw fermentorów Biogas Test Plant (BTPs)
Biogas test plant (BTPs) wyprodukowany przez firmę Umweltleistungen (UIT) to zestaw trzech fermentorów o pojemności 20 L, z oprzyrządowaniem służącym do kontroli najważniejszych parametrów procesu fermentacji metanowej, takich jak temperatura, pH, prędkość i cykl mieszania, ilość i skład biogazu – zawartość metanu, dwutlenku węgla, siarkowodoru i tlenu. Urządzenie pozwala na przeprowadzenie procesu fermentacji w trybie stacjonarnym, jak również ciągłym. Daje możliwość dodawania i pobierania próbki bez zakłócania trwającego procesu. Urządzenie rejestruje mierzone wartości powyższych parametrów, które następnie można przeglądać na ekranie monitora, wyświetlać w formie wykresów lub pobrać na nośnik pamięci.
Zastosowanie zestawu fermentorów:
- badania nad przebiegiem procesu fermentacji metanowej w trybie stacjonarnym i ciągłym, z wykorzystaniem różnych substratów, nad oceną ich przydatności do produkcji biogazu poprzez wyznaczenie uzysku biogazu i metanu,
- badania nad wpływem substancji szkodliwych lub stymulujących proces fermentacji metanowej,
- produkowanie osadu pofermentacyjnego z konkretnie dobranych substratów do badań nad jego nawozowym wykorzystaniem.
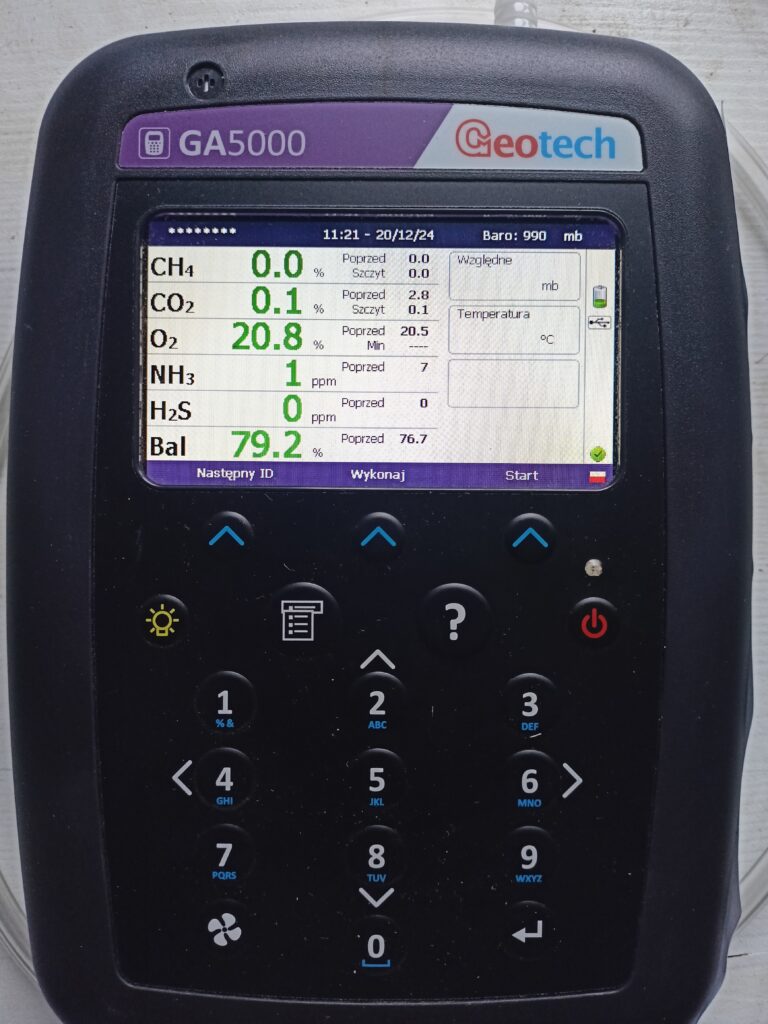 Przenośny analizator biogazu GA 5000
Przenośny analizator biogazu GA 5000
Przenośny analizator biogazu GA 5000 firmy GeoTech z dużym, kolorowym wyświetlaczem, wyposażony w czujniki podczerwieni do pomiaru zawartości metanu i dwutlenku węgla oraz elektrochemiczne cele pomiarowe do pomiaru zawartości tlenu, siarkowodoru i amoniaku. Urządzenie posiada certyfikat ATEX II oraz certyfikat kalibracji UKAS (ISO 17025). Analizator może być stosowany zarówno w laboratorium, jak i w terenie.
Zastosowanie analizatora:
- badanie składu biogazu pod kątem zawartości metanu, dwutlenku węgla i tlenu (w zakresie od 0 do 100% z dokładnością do 0.5%), siarkowodoru (w zakresie 0 – 10000 ppm) i amoniaku (w zakresie 0-1000 ppm).
Laboratorium przygotowania próbek
Zakład wyposażony jest w sprzęt umożliwiający przygotowanie próbek z zachowaniem wszelkiej ostrożności na każdym etapie, tak aby czynniki otoczenia nie wpływały na zawartość substancji chemicznie nietrwałych.



Liofilizator umożliwia liofilizację próbek w szerokim zakresie temperatur (-55°C) – (+50°C) i ciśnień (<0,01 mbar). Urządzenie pozwala na sublimacyjne usuwanie wody (oraz niektórych rozpuszczalników organicznych, np. t-BuOH, DMSO) w obniżonej temperaturze i pod zmniejszonym ciśnieniem, z zamrożonych roztworów oraz materiałów biologicznych, np. ekstraktów, zawiesin, całych roślin i owoców/warzyw. Dzięki zastosowaniu obniżonej temperatury możliwe jest suszenie próbek termolabilnych.
Liofilizacja jest wykonywana na 5 półkach o średnicy 20 cm oraz 3 półkach o średnicy 37 cm.

Ekstraktor pozwala znacznie skrócić czas ekstrakcji i zmniejszyć zużycie rozpuszczalnika nawet o 90%. Autosampler z 24 miejscowym rotorem oraz cele ekstrakcyjne dostępne w rozmiarach od 1 mL do 33 mL, umożliwiają wykonanie serii analiz próbek w szerokim zakresie wagowym. System umożliwia zastosowanie zarówno wodnych jak i organicznych rozpuszczalników. Możliwość sterowania temperaturą i ciśnieniem, przyspiesza kinetykę procesu ekstrakcji, nie dopuszczając do wrzenia rozpuszczalnika, co sprawia, że ekstrakcja jest bezpieczniejsza, szybsza i bardziej wydajna niż tradycyjne metody.
 Urządzenie do ekstrakcji mikrofalowej lotnych produktów naturalnych (Ethos X) wraz z wyposażeniem
Urządzenie do ekstrakcji mikrofalowej lotnych produktów naturalnych (Ethos X) wraz z wyposażeniem
Jest to urządzenie do bezrozpuszczalnikowej ekstrakcji, wykorzystujące technikę hydrodyfuzji mikrofalowej. Promieniowanie mikrofalowe nagrzewa wodę zawartą w komórkach materiału roślinnego poddawanego ekstrakcji, co powoduje rozerwanie ich ścianek i uwolnienie lotnych związków organicznych (olejki eteryczne). Olejki razem z parą wodną trafiają do chłodnicy zwrotnej, gdzie ulegają skropleniu, a następnie do odbieralnika. W porównaniu do klasycznej metody destylacji z parą wodną zaletą ekstrakcji mikrofalowej jest krótki czas procesu oraz większa wydajność procesu. Urządzenie to w konfiguracji z odbieralnikiem grawitacyjnym umożliwia otrzymanie mniej lotnych związków organicznych.

Wyparka ta umożliwia pracę w skali półtechnicznej. Pozwala na odparowanie rozpuszczalników organicznych jak i wody z ekstraktów roślinnych i innych materiałów przy zachowaniu niskiej temperatury roztworu, co jest bardzo ważne przy przetwarzaniu wrażliwych na temperaturę substancji. Chemoodporna pompa próżniowa KNF SBC LABOBASE 860 (60 L/min, ciśnienie końcowe 2 mbar) i wydajna chłodnica zasilana cyrkulatorem Huber Unichiller UC025 (2,5 kW przy 15° C) pozwalają na szybkie odparowanie cieczy w szerokim zakresie temperatur wrzenia. Dodatkowo, możliwe jest odparowanie roztworów wykazujących tendencję do rozpryskiwania i pienienia się. Wyparka wyposażona jest w kolby o pojemności 10 i 20 litrów.



